鈦及鈦合金材料在核工業、化工石化、航空航天、體育用品、牙科和醫療修復等領域得到廣泛的應用[1-2]。鈦合金材料也被認為是替代或修復失效硬組織(結構生物醫學應用)的最佳選擇材料[3]。由于表面形成氧化層而產生優異的耐腐蝕性以及較低的彈性模量, 鈦合金比任何其他醫學應用材料, 如不銹鋼、工業純(CP)Nb、Cr-Co 合金及CP-Ta 等更能滿足性能要求[4]。醫用鈦合金的發展歷程如圖1 所示。
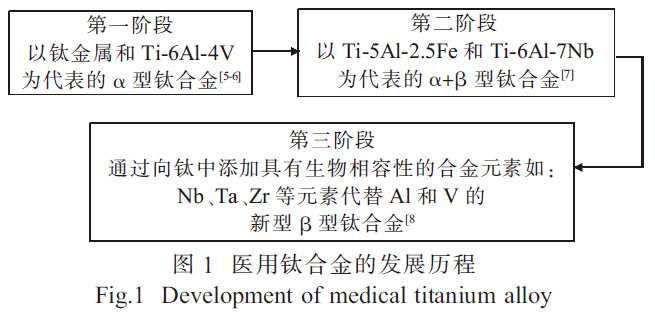
純鈦金屬抗腐蝕性能較好, 但其生物相容性與綜合力學性能較差, 強度相對較低且生產成本較為昂貴,因此鈦合金成為良好的替代品[8]。Ti-6Al-4V合金一直是醫用鈦合金的主要成分,然而,對于永久性植入應用, 該合金因釋放釩和鋁而產生的毒性效應限制了其在醫學上的應用[9]。因此,新型醫用鈦合金在Ti-6Al-4V 合金的基礎上, 引入了無釩和無鋁合金作為醫療應用。為降低生產成本和提高使用性能,醫用鈦合金的制備工藝也成為了研究的重點。
1 、粉末冶金
粉末冶金(PM)法[10-11]具有接近最終金屬成形的性能, 一直被推薦作為生產低成本鈦合金零件的有效方法[12],其方法流程[13]如下,①首先制備合金粉末;②將粉末元素進行混合;③室溫將混合粉末進行模壓; ④在可控氣氛爐中燒結以在粉末元素之間建立結合;⑤進行后期處理。合金與降低制造成本的最大化來自于所選的起始原料、合金元素和用于生產合金的加工步驟的組合。
整體形成β 相結構是有效降低鈦合金彈性模量的途徑,因此,可加入無毒β 穩定元素。Li等[14]以球形鈦粉、非球形鈮粉、非球形鋯粉和近球形錫粉為原料,采用粉末冶金法將幾種粉末經過混合、冷壓以及燒結,成功制備了Ti-24Nb-4Zr-8Sn(wt%)合金,其極限拉伸強度為760MPa,彈性模量為56.9GPa,斷裂應變為15.3%, 提高了該合金在生物醫學中所需的力學性能。在骨科臨床醫學應用中,提高植入物的生物相容性以及與人體骨骼的融合能力是必要的。Xu等[15]首先利用連續惰性氣體霧化法制備Ti35.4Zr28Nb 粉體,采用粉末冶金法制備了新型多孔Ti35Zr28Nb 支架材料,具有(132.5±3.5)MPa 的壓縮屈服強度以及(2.9±0.4)GPa 的彈性模量等優異的力學性能,可作為理想的骨植入材料。在制粉過程中對霧化技術的改進,提高粉末壓縮性和均勻性還有待提高。

在鈦環、鈦絲等鈦合金研發中含有更多的普通低成本、低熔點元素越來越受到重視, 降低了昂貴稀有金屬的含量從而降低了生產成本。Ehtemamhaghighi等[16]采用Ti 粉、Mn粉、Nb 粉為原料,將粉末充分混合2 h,在壓力550MPa 下對混合粉末進行模壓,在高溫管式爐中將壓坯升溫至1170℃保溫8h 后冷卻, 采用粉末冶金方法, 從混合元素粉末中制備一系列新型Ti-Mn-Nb合金, 通過硬度和壓縮試驗獲得的力學性能表明,Ti-7Mn-xNb 合金具有比純鈦金屬材料具有更高的硬度以及更低的彈性模量。
采用粉末冶金工藝可制備出性能良好的醫用鈦合金,也可制備出凈成形的合金,大大減少了后期的處理工作,但對制粉要求較高,且燒結溫度基本都在高溫(>1000℃)下進行,從而增加了反應的能耗。
2、 機械合金化
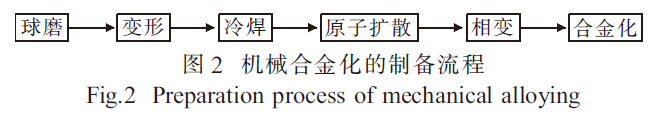
機械合金化(MA)[17-18]廣泛用于均勻化和混合元素粉末, 以進一步在固態下利用元素粉末制備合金。其制備流程[19]如圖2 所示,可通過快速焊接和斷裂在原子水平上將元素粉末混合在一起。在制備磁性、超導等材料中取得了很大進展[20]。隨著研究工作的深入, 機械合金化技術將在新材料制備中發揮更大的作用。
鈦合金本身一般不具有抗菌性能, 并且由于植入物引起相關的感染而導致術后并發癥或植入失敗等難題,研究者將無機抗菌劑引入鈦合金中,制備了抗菌生物醫用合金材料[21]。Li等[22]采用工業純Ti 粉和Bi 粉經機械合金化和后續的放電等離子燒結技術制備了二元Ti-Bi 合金,Ti-Bi 合金的壓縮屈服強度比工業純Ti (CP-Ti) 合金的高約22%~44%,當
Bi 含量為0.5%時,Ti-Bi 合金具有約1080MPa 的屈服強度以及約2226MPa 的極限抗壓強度,斷裂應變約34.3%, 在生物醫學中表現出優異的塑性及綜合力學性能。在鈦合金的合金元素中,Mo 是一種很強的β 相穩定劑,能提高鈦合金的耐蝕性,從生物學的角度來看,Mo 是許多對細胞代謝重要的酶的必需微量元素[23]。Ag 具有更好的抗菌作用,同時保持了與純Ti 相似的生物相容性。Zhang等[24]利用具有β 相的穩定元素Mo 和抗菌元素Ag, 以原子比為18∶1∶1 的純Ti、Mo 和Ag 為起始原料, 采用機械合金化和放電等離子燒結相結合的方法制備了大塊細粒Ti-5Mo-5Ag 合金,900℃燒結的合金呈現出89%的β 相基體,平均晶粒尺寸為(8.1±3.2)μm,11%的α 相在晶界/ 三界處有微米/ 亞微米級析出相的網狀組織,其屈服強度高達(1694±8.4)MPa,斷裂應變為23%。與純Ti 相比,所制備的Ti-5Mo-5Ag 合金還表現出較強的耐蝕性和優異的抗菌活性。
機械合金化優點是時間短、能耗低、涂層附著力好、形成各種結構涂層的柔韌性好,可很容易地獲得所需的化學成分和結構的涂層。
3、增材制造技術
增材制造(AM)技術[25-26],也稱為3D 打印技術,以3D 模型將材料連接起來逐層進行數據制備合金的工藝,與減材制備合金技術相反。它涵蓋了一系列使用逐層方法來構建零件或產品的技術, 主要有電子束熔煉技術和選擇性激光熔化[27],以粉末為原料的AM 技術是制造金屬合金材料最常用的方法。
3.1 電子束熔煉技術
電子束熔煉(EBM)技術[28-29]是以電子束為熱源,在高溫、高真空條件下使用前體金屬粉末精確分層制備復雜金屬合金結構。根據3D 模型,來自焊槍的電子束由偏轉線圈控制并聚焦在金屬粉末床上,粉末通過熔化與電子束反應, 然后由兩個粉末盒添加另一粉末層, 新粉末通過粉耙均勻地分布在整個表面上,并且該過程以逐層方式繼續進行,直到零件達到最終成形[30]。此外,EBM 技術還可加工高熔點或高硬度的金屬, 這些顯著的優點使得EBM 不僅在工業上,而且在醫學領域都具有極大的吸引力,能使植入物準確地適應不同的缺陷位置。
采用多孔結構可以降低鈦合金零件與人體骨骼之間的模量差。Chen等[31]以預合金Ti-6Al-4V 粉末為原料, 采用電子束熔化技術制備了具有金剛石晶格韌帶結構、孔隙率高達80%的多孔Ti-6Al-4V 泡沫材料,對于所有80%孔隙率的不同韌帶寬度和孔徑的EBM 泡沫材料, 可以很好匹配人體松質骨的楊氏模量和應力水平, 有效降低應力遮擋效應的風
險。Almanza等[32]以Ti-6Al-4V 合金粉末采用電子束熔煉技術制備了Ti-6Al-4V 合金,降低了0.50~0.14mm/a 的腐蝕速率,可提高長期植入物的抗腐蝕性。

電子束熔煉技術可用于制備難以加工、需要昂貴工具的合金。真空條件為電子束熔煉提供了一個可控的環境,以傳統的方式減少了制備合金的缺陷,從而提高了合金的耐腐蝕性等。
3.2 選擇性激光熔化
選擇性激光熔化(SLM)[33-34]技術是一種分層的成形工藝, 能實現高幾何復雜度的合金零件接近凈形狀生產,它是對傳統鈦合金零件生產路線(如鍛造和鑄造)的補充。在SLM 中,在粉末床上鋪上一薄層金屬合金粉末,并用高功率激光選擇性地熔化,這個過程逐層重復,直到制備出整個合金零件[35]。由于SLM 獨特的成形工藝,不同的成形方向得到不同的織構成分, 從而使醫療器械或植入物具有不同各向異性的性能。
在生物醫學中, 選擇性激光熔化制備的最終植入物是通過積累層獲得,除了致密的植入物外,SLM還可制造具有格狀結構的定制植入物, 從而使新骨組織向內生長并輸送體液。Luo等[36]首先通過等離子旋轉電極法制備Ti-30Nb-5Ta-3Zr(TNTZ)合金粉末,再采用選擇性激光熔化制備了Ti-30Nb-5Ta-3Zr合金,TNTZ 的拉伸強度、楊氏模量、伸長率和疲勞極限分別為~680 MPa,~64.2 GPa,~15.3%和~140MPa。當孔隙率為77.23%(體積) 的晶格結構時,TNTZ 樣品屈服強度范圍為15.7~520MPa,可用于修復或代替人類皮質骨, 沒有細胞毒性, 并且比Ti-6Al-4V 表現出更好的生物相容性,低應力屏蔽趨勢和較高的力學性能。增材制造技術可用于制備生物醫學應用的開孔金屬支架, 與傳統的制造工藝相比,具有許多優勢。Li等[37]首先使用可消耗電極真空電弧爐熔融法制備出Ti35Zr28Nb 合金錠,再利用等離子體旋轉電極霧化系統將合金錠霧化成球形粉末, 最后采用選擇性激光熔化制備用于生物醫學應用的塊狀和多孔狀新型β-Ti35Zr28Nb 合金支架。得出:①SLM 制備的大塊樣品在縱向和橫向分別顯示出57、60GPa 的彈性模量, 以及612、768MPa 的壓縮屈服強度;②SLM 制備的孔隙率為83%的支架在縱向和橫向上的彈性模量值分別為1.1、0.7GPa,抗壓屈服強度值分別為27、8MPa;③SLM 制造的孔隙
率為50%的支架在縱向和橫向上的彈性模量值為1.3、1.0 GPa, 抗壓屈服強度值分別為58、45MPa,SLM 制備的Ti35Zr28Nb 支架具有良好的腐蝕性能和生物相容性。

選擇性激光熔化技術能夠使用合金粉末直接制備復雜的網狀植入物, 具有可用于生物醫學應用中定制植入物結構的特點,然而,也存在著成本高、效率低等缺點。
4、 結語與展望
(1) 鈦絲、鈦棒等鈦合金與純金屬材料相比,具有獨特的生物醫學應用優勢, 已被用作制造骨科假體和牙種植體的結構生物材料中,可改善患者的健康狀況,使患者能無痛苦正常生活,延長人類壽命。
(2) 粉末冶金法是制備生物醫療器械的傳統方法, 使用預合金或混合元素等不同類型的粉末可擴大不同應用,達到所需要的性能范圍;可降低制備成本,將部件制備達到接近凈形狀,但模壓過程中需要的模具成本較高。
(3) 機械合金化能有效降低合金化溫度,簡化難熔元素合金的制備,通過調節工藝參數,可以很容易地獲得均勻、精細、甚至納米晶的微觀結構。因此,通過機械合金化可以制備出化學成分分布均勻、納米晶體結構的材料, 氣體環境也可能會影響合金的性能, 對于制備特殊的合金更需要成本較高的特殊氣體作為保護氣。
(4) 電子束熔煉法能在不使用傳統工具、低制造成本、更快的時間和最少的人為干預的情況下,更精確地獲得尺寸可控、幾何形狀更復雜的產品,可以獲得較短的制備周期,省略大量的機械加工,可以降低材料的制備成本和制備產生的廢料, 從而降低對環境的影響,但在制備過程中對真空度要求較高。選擇性激光熔化能經濟高效地制備復雜形狀的致密合金,制備步驟少,靈活性好并且材料利用率較高,可直接獲得與鍛造合金一樣的優異力學性能。在真空條件下,氣體的體積將大大減小,提高合金材料的質量, 但金屬材料的加熱和冷卻速率也可能會強烈影響最終材料的力學性能與生物相容性。
(5) 提高生物醫用鈦合金材料與人體的相容性、降低合金材料在使用過程中產生的應力屏蔽效應以及醫用鈦合金的彈性模量等性能是未來的研究方向, 使新型醫用鈦合金材料在人體中不產生副反應。采用二種或多種方法結合降低制備成本提高制備效率, 研究出最適合綠色工業化生產生物醫用鈦合金的工藝。
參考文獻:
[1] Oh J M, Park C H, Yeom J T, et al.High strength andductility in low-cost Ti-Al-Fe-Mn alloy exhibitingtransformation-induced plasticity [J]. Materials Science andEngineering A,2020,772:138813-138822.
[2] 周泉, 丁澤良, 王易, 等.Ti6Al4V 鈦合金表面Ta2O5/Ta2O5-Ti/Ti 多涂層的制備與性能研究[J]. 包裝學報,2019,11(6):23-30.
[3] Yan L, Yu J, Zhong Y,e t al. Influence of scanning on nanocrystalline β-Ti alloys fabricated by selective laser melting andtheir applications in biomedical science [J].Journal ofNanoscience and Nanotechnology,2020,20(3):1605-1612.
[4] Jackson M J, Kopac J, Balazic M, et al. Titanium andtitanium alloy applications in medicine[M].Surgical Tools andMedical Devices:Springer,Cham,2016:475-517.
[5] 張遠. 醫用純鈦及Ti-6Al-4V 表面微納結構的制備及生物相容性研究[D].長沙:湖南大學,2018.
[6] Li X P, Ji G, Eder K, et al. Additive manufacturing of anovel alpha titanium alloy from commercially pure titaniumwith minor addition of Mo2C[J].Materialia,2018,4:227-236.
[7] Jia M T, Gabbitas B, Bolzoni L.Evaluation of reactiveinduction sintering as a manufacturing route for blendedelemental Ti-5Al-2.5Fe alloy [J].Journal of MaterialsProcessing Technology,2018,255: 611-620.
[8] Weng W J, Arne B, Li Y C, et al. Effects of selectedmetallic and interstitial elements on the microstructure andmechanical properties of beta titanium alloys for orthopedicapplications[J]. Materialia,2019,6:100323-100332.
[9] Elias C N, Lima J H C, Valiev R, et al.Biomedicalapplications of titanium and its alloys [J]. Jom,2008,60(3):46-49.
[10] Guo W M, Liu B, Liu Y, et al. Microstructures and mechanical properties of ductile NbTaTiV refractory high entropy alloyprepared by powder metallurgy [J].Journal of Alloys andCompounds,2019,776: 428-436.
[11] 魏文慶,曹光明,劉炳強,等.粉末冶金Nb-35Ti-6Al-5Cr-8V合金組織演變及其力學行為[J]. 稀有金屬材料與工程,2019,48(12):4106-4112.
[12] Niu H Z, Zhang H R, Sun Q, et al. Breaking through thestrength-ductility trade-off dilemma in powder metallurgyTi-6Al-4V titanium alloy[J].Materials Science and EngineeringA,2019,754:361-369.
[13] Nassar A, Nassar E.Properties of aluminum matrix Nanocomposites prepared by powder metallurgy processing [J].Journal of King Saud University: Engineering Sciences,2017,29(3):295-299.
[14] Li X, Ye S L, Yuan X N, et al. Fabrication of biomedicalTi-24Nb-4Zr-8Sn alloy with high strength and low elasticmodulus by powder metallurgy [J]. Journal of Alloys andCompounds,2019,772: 968-977.
[15] Xu W, Tian J J, Liu Z, et al. Novel porous Ti35Zr28Nbscaffolds fabricated by powder metallurgy with excellentosteointegration ability for bone-tissue engineering applications[J].Materials Science and Engineering C,2019,105:110015-110024.
[16] Ehtemamhaghighi S, Attar H, Dargusch M S, et al.Microstructure,phase composition and mechanical properties ofnew,low cost Ti-Mn-Nb alloys for biomedical applications [J].Journal of Alloys and Compounds,2019,787:570-577.
[17] Jiang J, Shen Y F, Feng X M.Microstructure evolution,formation mechanisms and properties of SiCp/Al compositecoatings on Ti-6Al-4V substrate via mechanical alloying method[J]. Surfaces and Interface,2020,19:100487-100496.
[18] 顏建輝,李凱玲,汪異,等.機械合金化和放電等離子燒結制備NbMoCrTiAl 高熵合金[J]. 材料導報,2019,33 (10):1671-1675.
[19] Suryanarayana C. Mechanical alloying and milling [J].Progress in Materials Science,2001,46(1/2):1-184.
[20] Tian Y, Shen Y, Lu C, et al. Microstructures and oxidationbehavior of Al-CrMnFeCoMoW composite coatings onTi-6Al-4V alloy substrate via high-energy mechanical alloyingmethod [J]. Journal of Alloys and Compounds,2019,779:456-465.
[21] Lei Z M, Zhang H Z, Zhang E L, et al. Antibacterialactivities and biocompatibilities of Ti-Ag alloys prepared byspark plasma sintering and acid etching [J]. Materials Scienceand Engineering C,2018,92:121-131.
[22] Li Z J, Dong A P, Xing H, et al. Microstructure andmechanical properties of bimodal TiBi alloys fabricated bymechanical alloying and spark plasma sintering for biomedicalapplications [J].Materials Characterization,2020,161:110134-110145.
[23] Chen Q Z, Thouas G A.Metallic implant biomaterials [J].Materials Science and Engineering: R: Reports,2015,87(87):1-57.
[24] Zhang Y W, Chu K J, He S, et al.Fabrication of highstrength,antibacterial and biocompatible Ti-5Mo-5Ag alloy formedical and surgical implant applications[J].Materials Scienceand Engineering C,2020,106:110165-110173.
[25] 王祥,張林杰,李森,等.增材制造Ti-6Al-4V 組織的演化與拉伸性能的差異[J].航空制造技術,2019,62(17):88-94.
[26] Neikter M, 魡kerfeldt P, Pederson R, et al. Microstructuralcharacterization and comparison of Ti-6Al-4V manufacturedwith different additive manufacturing processes [J].MaterialsCharacterization,2018,143:68-75.
[27] Fojt J, Fousova M, Jablonska E, et al.Corrosion behaviourand cell interaction of Ti-6Al-4V alloy prepared by two techniquesof 3D printing [J].Materials Science and EngineeringC,2018,93:911-920.
[28] Hara D, Nakashima Y, Sato T, et al.Bone bonding strengthof diamond-structured porous titanium-alloy implants manufacturedusing the electron beam-melting technique [J]. MaterialsScience and Engineering C,2016,59:1047-1052.
[29] 李建兵,馬治龍,王強,等.電子束法生產金屬釩用釩鋁合金制備工藝的研究[J].湖南有色金屬,2019,35(4):39-42.
[30] Fiaz H S, Settle C R, Hoshino K.Metal additivemanufacturing for microelectromechanical systems:titaniumalloy (Ti-6Al-4V)-based nanopositioning flexure fabricated byelectron beam melting [J].Sensors and Actuators A: Physical,2016,249:284-293.
[31] Chen S Y, Kuo C N, Su Y L, et al. Microstructure andfracture properties of open-cell porous Ti-6Al-4V with highporosity fabricated by electron beam melting [J]. MaterialsCharacterization,2018,138:255-262.
[32] Almanza E, Pérez M J, Rodríguez N A, et al.Corrosionresistance of Ti-6Al-4V and ASTM F75 alloys processed byelectron beam melting [J].Journal of Materials Research andTechnology,2017,6(3):251-257.
[33] Jiang X J, Chen G Y, Men X L, et al. Grain refinement andexcellent mechanical properties of a Ti-based alloy via lasermelting and subsequent low temperature annealing[J]. MaterialsScience and Engineering A,2018,737:182-187.
[34] 彭丹華,張正文,張凱飛,等.選擇性激光熔化成形Ti6Al4V鈦合金的滾動接觸疲勞性能研究[J].機械強度,2019,41(1):60-65.
[35] Moridi A, Demir A G, Caprio L, et al. Deformation andfailure mechanisms of Ti-6Al-4V as built by selective lasermelting [J]. Materials Science and Engineering A,2019,768:138456-138465.
[36] Luo J P, Sun J X, Huang Y F, et al. Low-modulusbiomedical Ti-30Nb-5Ta-3Zr additively manufactured bySelective Laser Melting and its biocompatibility [J].MaterialsScience and Engineering C,2019,97: 275-284.
[37] Li Y C, Ding Y F, Munir K S, et al. Novel β-Ti35Zr28Nballoy scaffolds manufactured using selective laser melting forbone implant applications [J].Acta biomaterialia,2019,87:273-284.
相關鏈接












