醫(yī)用鎳鈦合金是一種鎳 / 鈦原子比相近的金屬間化合物,因其具有獨特的形狀記憶效應、優(yōu)良的力學性能和生物相容性,是制作醫(yī)療植入器械的理想材料[1,2]。例如,在心血管支架方面,利用鎳鈦合金形狀記憶效應制造的自膨脹型支架,避免了球囊擴張型支架在球囊撤出后徑向回彈的問題,減少血管再狹窄發(fā)生[3];在外科矯形器械方面,鎳鈦合金彈性模量約為 67GPa,低于不銹鋼和純鈦,更加接近皮質(zhì)骨彈性模量,利于減輕因應力屏蔽產(chǎn)生的骨骼愈合緩慢等問題,廣泛應用于髓內(nèi)釘、加壓接骨器、環(huán)抱內(nèi)固定器和脊柱矯形棒等醫(yī)療器械。
鎳鈦表面存在 2~20nm 厚的 TiO2保護層,賦予鎳鈦良好的生物相容性以及耐腐蝕性,但這種自然氧化層通常不夠致密,在生理環(huán)境長期腐蝕作用下,可能發(fā)生剝落或點蝕現(xiàn)象,導致鎳離子釋放進入細胞。鎳離子含量過高可能會破壞細胞器,改變細胞形態(tài),產(chǎn)生過敏、炎癥等不良反應。此外,研究發(fā)現(xiàn)血管發(fā)生支架內(nèi)再狹窄現(xiàn)象與鎳離子的過量釋放有關(guān)[4-6]。
鎳鈦合金本身是生物惰性材料,植入體與骨組織以機械嵌合方式連接,骨整合性能欠佳,同時面臨著細菌感染等問題[7,8]。因此,需對鎳鈦合金進行表面改性,改善其耐腐蝕性,賦予其廣譜抗菌、促成骨、抗凝血等多種生物學功能[9-11]。
本文綜述了近年來醫(yī)用鎳鈦合金表面改性研究進展,根據(jù)改性過程中涂層與基體是否發(fā)生化學反應,將改性方法歸類為物理表面改性、化學表面改性及復合表面改性,重點介紹了各改性方法的改性機理、技術(shù)特點以及所得涂層的理化特性和生物學性能。
1、 物理表面改性
物理表面改性主要包括等離子噴涂、磁控濺射、等離子體浸沒離子注入、激光表面改性以及電泳沉積,各改性方法制備的涂層及其特點詳細介紹如下。
1.1 等離子噴涂
等離子噴涂(Plasma Spraying)是通過等離子電弧產(chǎn)生高溫將材料熔化、熔融粒子沉積到基體表面形成涂層的表面改性技術(shù),該方法操作簡單、設(shè)備成本較低、沉積速率高,調(diào)節(jié)電弧功率、等離子體流速、噴涂時間等參數(shù)可以獲得不同性質(zhì)的涂層,可改善基體的耐腐蝕性、耐磨性等,但不適合結(jié)構(gòu)復雜的表面改性。已有研究利用等離子噴涂技術(shù)沉積 ZrO 2[12]、羥基磷灰石Ca 10 (PO 4 )6 (OH) 2(HAP)[13,14] 等材料到植入體表面,提高其耐蝕性和生物相容性。
Prymak 等[15] 采用等離子噴涂技術(shù)在鎳鈦表面制備了羥基磷灰石涂層,呈典型的液滴固化形貌,涂層與基體結(jié)合強度良好,可以承受一定程度彎曲變形而不開裂。除了活性生物陶瓷,生物相容性優(yōu)良的金屬也被作為涂層材料。鉭(Ta)[16] 噴涂到鎳鈦表面形成含微晶結(jié)構(gòu)的涂層,在模擬體液中進行的電化學實驗表明鉭涂層顯著提升鎳鈦耐腐蝕性能,電偶電流 - 時間曲線顯示涂層與基體電流密度為微安級,幾乎不發(fā)生電偶腐蝕。
1.2 磁控濺射
磁控濺射(Magnetron Sputtering)技術(shù)來源于強化放電理論,高真空條件下通入適量氬氣,在電場作用下氬氣電離并獲得很高的能量,氬離子轟擊靶材表面,靶材中的原子或分子濺射到基體表面形成特定功能涂層。磁控濺射技術(shù)具有沉積速率快、鍍層緊密均勻、靶材種類多樣等特點。
利用磁控濺射技術(shù)可在鎳鈦表面制備金屬、合金以及陶瓷薄膜。Ji 等[17] 以鋯為靶材,在鎳鈦表面濺射鋯涂層,研究表明涂層表面平整,與基體結(jié)合緊密,晶體結(jié)構(gòu)與靶材一致,并伴有少量 ZrO2陶瓷相。Yuan 等[18] 利用磁控濺射技術(shù)在鎳鈦表面沉積了一層 TiO2薄膜,研究表明改性后鎳鈦耐腐蝕性能明顯提升,干細胞的粘附數(shù)量提高一倍。將材料植入兔子股骨,發(fā)現(xiàn)濺射 TiO2后,鎳鈦與骨組織結(jié)合更緊密,20d 后基本被新骨覆蓋,沒有骨折、水腫等不良反應,骨組織誘導能力比未改性鎳鈦高出9~10 倍。
1.3 等離子體浸沒離子注入
等離子體浸沒離子注入(Plasma ImmersionIon Implantation,PIII)是一種實現(xiàn)全方位均勻離子注入的表面改性技術(shù),原理如圖1 所示[19]。真空條件下,氣體通過輝光放電離化提供等離子源,或固體靶材通過電弧離化產(chǎn)生等離子體,基體浸沒在等離子體中,在基體上施加脈沖負高壓,排斥電子,形成正離子鞘層,在鞘層電場作用下,正離子獲得高能量,沿不同方向垂直、均勻地注入到基體表面。PIII技術(shù)能夠單一或同時注入多種元素,改性層與基體結(jié)合緊密,沒有明顯界限,適合復雜形狀材料的表面改性。
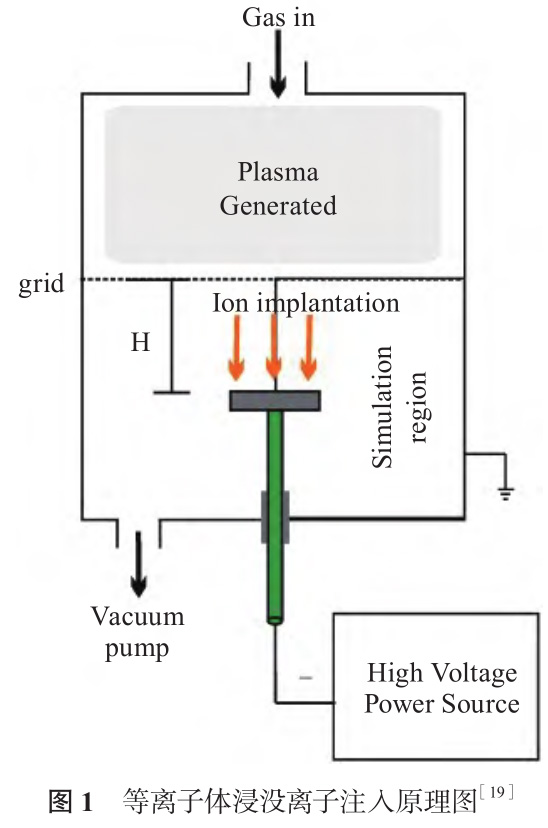
Maleki-Ghaleh 等[20] 研究了氮離子注入對鎳鈦表面生物學性能的影響。氮離子注入改性所得鎳鈦表面形成了TiN 和 Ti2N 相,且隨著氮離子注入劑量增加,耐腐蝕性提高。氮離子注入量為1.4×10 18 ion/cm 2的改性鎳鈦表面耐蝕性最好,鎳離子釋放量最低。
增大注入量其耐蝕性反而下降,原因可能是高劑量注入時原子晶格應變量增加,基體產(chǎn)生較多表面應力,加速了電化學腐蝕反應。通過成纖維細胞培養(yǎng)評價改性鎳鈦的生物相容性,發(fā)現(xiàn)注氮鎳鈦為細胞粘附提供更多的活性位點,細胞鋪展面積明顯高于未改性鎳鈦。以 C2H2為碳源進行碳離子注入可制備 DLC 膜[21],可顯著改善鎳鈦耐腐蝕性能,抑制鎳離子析出,改性鎳鈦在漢克溶液中浸泡 20d 鎳離子釋放量接近于零,同時電化學腐蝕后表面仍保持平整。
金屬材料常用作陰極靶材,注入到鎳鈦表面可賦予其特定生物學功能。Zhao 等[22] 采用 PIII 技術(shù)在鎳鈦表面注鉭,鎳離子釋放量降低 40%,成骨細胞增殖程度提高,且呈現(xiàn)更好的黏附形態(tài)。Wu等[23] 采用 PIII 技術(shù)在鎳鈦表面注入銅和氮元素,形成 Cu 3 N/Cu 微電池對,實現(xiàn)優(yōu)異的催化殺菌功能且具有良好的生物相容性。Wei 等[24] 采用兩步PIII 法,在基體表面原位構(gòu)建 Ni 3 N 薄膜,Ni 3 N 薄膜對金黃色葡萄球菌和大腸桿菌均具有 99% 以上的殺滅率。
1.4 激光表面改性
激光表面改性(Laser Surface Modifi cation)將激光技術(shù)與金屬表面熱處理結(jié)合,具有激光能量密度高、輸出功率準確可控的特點。涂層材料被激光照射后發(fā)生重熔,并與基體結(jié)合,從而改善基體耐蝕性、表面硬度、生物相容性等表面理化性質(zhì)。根據(jù)激光照射后涂層種類不同,常用于鎳鈦表面的激光表面改性技術(shù)可分為激光熔覆、激光氮化等。
激光熔覆是將涂層粉末提前噴涂到基體表面或與激光束同步送粉,粉末在激光束作用下快速熔化、擴散、凝固,生成無氣孔、無裂紋的冶金結(jié)合界面的技術(shù)。Yang 等[10] 將鈦粉與 HAP 粉末混合,均勻涂覆在鎳鈦表面,通過 Nd:YAG 激光器照射形成HAP/ 鈦復合涂層。不同區(qū)域元素含量分析結(jié)果顯示表層鎳含量比基體降低了一半,有效降低鎳離子釋放。涂層浸沒在漢克溶液中兩周,表面產(chǎn)生磷灰石層,表明 HAP/ 鈦復合涂層有效改善鎳鈦生物活性。
激光氮化是在氮氣氛圍中利用激光束熔化鎳鈦表面,凝固后形成致密的氮化鈦改性層,Zhang 等[25] 據(jù)此制備了氮化鈦涂層,顯著改善鎳鈦耐腐蝕性。Ng等[26] 用蒸餾水、二碘甲烷和 RPMI 1640 培養(yǎng)基評價激光氮化處理后樣品的親水性,發(fā)現(xiàn)接觸角均減小,這與氮化處理后表面能極性部分較高有關(guān)。親水表面更利于細胞附著,心肌細胞培養(yǎng) 48 h 后呈紡錘狀,鋪展面積顯著高于未改性鎳鈦。
1.5 電泳沉積
電泳沉積(Electrophoretic Deposition)是指待沉積材料粉末分散在膠體中,帶電粒子在電場作用下定向移動(電泳),均勻沉積到電極表面形成薄膜。
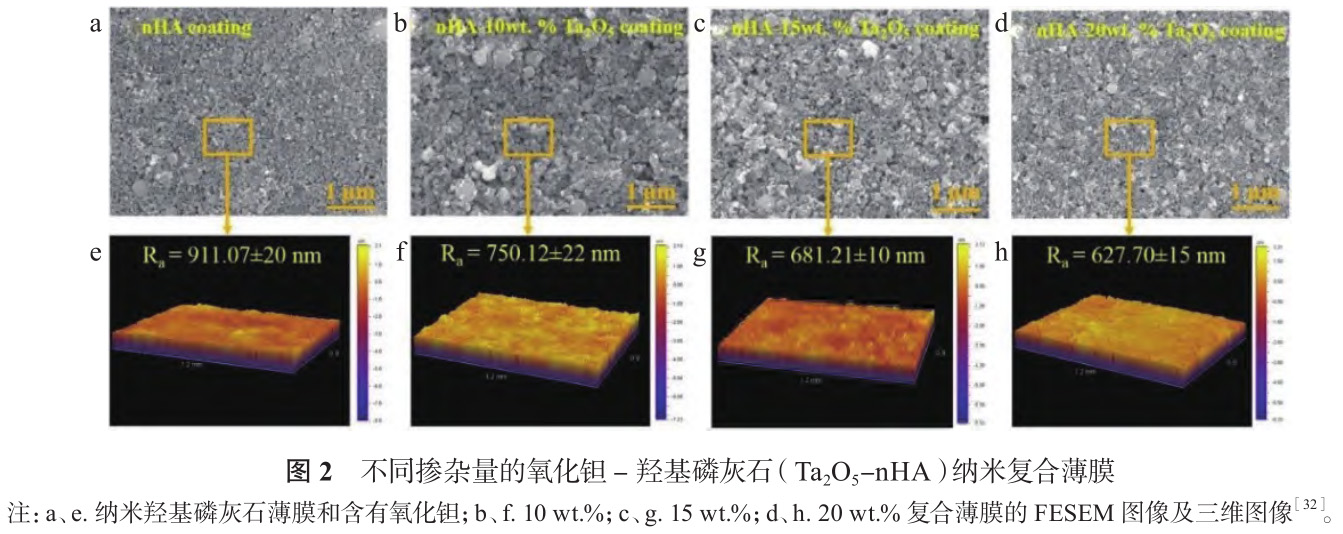
電泳沉積操作簡單,設(shè)備成本低廉,制備條件溫和,可防止薄膜發(fā)生脆裂或相變。電泳沉積被用于在金屬表面制備耐腐蝕性薄膜或生物活性陶瓷涂層。Khalili 等 [27] 對鎳鈦進行噴砂、酸蝕預處理,增大表面粗糙度,采用電泳沉積制備的 HAP 涂層結(jié)合強度比未預處理鎳鈦提高50%。引入 TiO2和 Y2O 3 等活性金屬氧化物第二相可改善其彈性模量、硬度等力學性能[28,29],克服 HAP 機械性能較差、負載條件下與基體結(jié)合強度不足等缺點[30,31]。Horandghadim 等[32] 利用電泳沉積在鎳鈦表面制備了不同摻雜量的氧化鉭 - 羥基磷灰石(Ta2O 5 -nHA)納米復合薄膜,如圖2所示。沉積過程中 Ta2O 5 粒子填充薄膜孔隙,使表面愈加平整,填充量越高,平均粗糙度越低,薄膜越緊密,利于阻礙鎳離子進入組織,20 wt.% Ta2O 5 -nHA 薄膜鎳離子釋放量比未改性鎳鈦減少 90%,彈性模量和硬度分別為(32.85±3.23)GPa 和(2.38±0.18)GPa,與骨骼力學性能接近,利于減輕植入體產(chǎn)生的應力屏蔽效應。
2、 化學表面改性
化學表面改性主要包括電化學沉積、陽極氧化、微弧氧化、溶膠- 凝膠法、化學氣相沉積、水熱法以及共價枝接,各類方法制備的涂層及其特點詳細介紹如下。
2.1 電化學沉積
電化學沉積(Electrochemical Deposition)是指電場作用下離子遷移到電極表面發(fā)生氧化還原反應形成涂層的技術(shù)。Li 等[33] 將殼聚糖和硝酸銀混合溶解到乙酸中作為電解液,在鎳鈦表面沉積了殼聚糖 / 銀復合涂層,抑菌環(huán)實驗結(jié)果顯示殼聚糖 / 銀復合涂層產(chǎn)生的抑菌環(huán)明顯大于單一沉積銀或殼聚糖,表明復合涂層具有協(xié)同抗菌效果。Hammad 等[34]以硝酸鋅為電解液,采用三電極體系在鎳鈦正畸弓絲表面沉積氧化鋅涂層。研究顯示獲得了穩(wěn)定附著的氧化鋅涂層,摩擦力比未改性鎳鈦弓絲降低 34%,涂層對金黃色葡萄球菌、化膿性葡萄球菌和大腸桿菌均具有顯著抗菌活性。
2.2 陽極氧化
陽極氧化(Anodic Oxidation)是一個電化學反應過程,待處理金屬連接陽極發(fā)生氧化反應,得到氧化層。氧化過程中陽極發(fā)生部分溶解,通常在中性或弱堿性電解液中得到致密氧化膜,在含 F - 、Cl - 的酸性電解液中形成多孔氧化層,是由于酸性條件下氧化層溶解速率加快,F(xiàn) - 、Cl - 在電場作用下對其具有刻蝕作用 [35] 。電解液種類、外加電流電壓、反應溫度和時間等對制得氧化膜的理化性質(zhì)均具有重要影響。
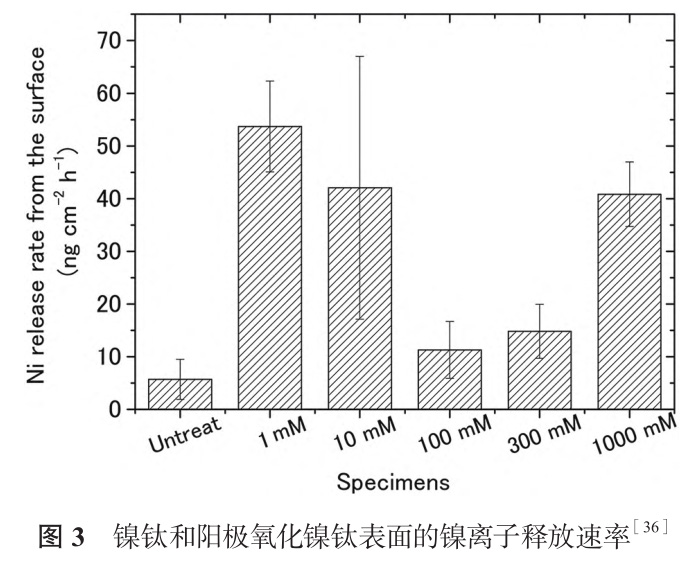
陽極氧化適合在 Ti、W、Zr、Hf、Ta 等少數(shù)幾種金屬表面構(gòu)建納米管結(jié)構(gòu),但由于鎳鈦合金含有 Ni 元素,納米管的形成較為困難。Ohtste 等[36] 使用不同濃度的硝酸電解液對鎳鈦進行陽極氧化,制備納米孔氧化層,納米孔大小隨硝酸濃度增加而增加,鎳離子的釋放量不是類似的線性關(guān)系,如圖3所示。鎳離子析出受氧化層厚度與表面孔隙率雙重影響,硝酸濃度低于100mM 時,氧化層厚度占主導因素,氧化層厚度隨硝酸濃度增加,鎳離子釋放量減少,濃度高于100mm 時,孔隙率占主導因素,濃度升高孔隙率增大,鎳離子釋放量增加。
為評估鎳離子釋放動力學行為對細菌、細胞生理活性的影響,Hang 等[37] 使用含 5.0 vol.% H2 O和 0.3mol NaCl 的乙二醇為電解液,施加 10V 電壓在鎳鈦表面制備了長度從 0.55~114μm 的納米孔氧化層。鎳離子釋放量與納米孔長度成正比,當長度小于11μm 時,涂層呈良好的細胞相容性,長度大于11μm 時,涂層對細胞產(chǎn)生抑制作用,金葡菌抑菌率達到100%。值得注意的是,即使納米孔長度為1μm,抑菌率也可達到 80%。
2.3 微弧氧化
微弧氧化(Miro-arc Oxidation)由陽極氧化發(fā)展而來,因此二者在技術(shù)上有相似之處,最大的區(qū)別就是微弧氧化外加電壓更高,在金屬表面產(chǎn)生火花放電現(xiàn)象,原位生成致密氧化膜。微弧氧化技術(shù)不需要在真空等特殊條件下進行,設(shè)備簡單、工藝穩(wěn)定,通過改變電解液組分、氧化時間、電極材料等調(diào)控氧化膜性能,制備出顏色各異、成分不同、具有特定生物學功能的氧化膜。Yesildal 等[38] 配 制了含 NaAlO2 、NaH2PO2和Na2SO 4 的 NaOH 電解液,pH 調(diào)至11,采用微弧氧化技術(shù)在鎳鈦表面制備出厚度均勻的 TiO2涂層。模擬體液中浸泡 21d 后發(fā)現(xiàn),未改性鎳鈦表面析出的鎳離子總量隨時間逐漸增加,并在第21天達到最大值,微弧氧化后鎳鈦合金釋放的鎳離子濃度在 21d 內(nèi)均低于檢測限。差熱法結(jié)果顯示未改性鎳鈦在模擬體液中浸泡 21d 后重量增加 0.071g,鎳鈦經(jīng)過微弧氧化處理后,重量增加 0.6619g,表面覆蓋類骨結(jié)構(gòu)磷灰石。
2.4 溶膠- 凝膠法
溶膠 - 凝膠(Sol-gel)反應過程包括以下四步[39]:①高反應活性前驅(qū)體(金屬醇鹽是最常用的金屬基前驅(qū)體)通過水解反應得到水和醇鹽的均相溶液;②溶液中的水解分子發(fā)生縮聚反應,形成溶膠;③膠體粒子進一步縮聚構(gòu)成三維網(wǎng)絡,形成凝膠;④熱處理除去凝膠內(nèi)的溶劑,得到多孔或致密涂層。溶膠- 凝膠法制備過程簡單靈活,涂層厚度可控,幾乎不改變基體原始形貌,不同反應物之間可能在分子水平上均勻混合,在合成納米復合涂層方面有獨特優(yōu)勢。
Fu 等[40] 用 NaOH、HCl 先后對鎳鈦進行預處理構(gòu)建鈦酸鹽多孔層,將其作為中間層,然后將鈦酸四丁酯、二乙醇胺溶解在乙醇中得到前驅(qū)體溶液,控制浸漬-干燥次數(shù)調(diào)控 TiO2涂層厚度。研究表明,在拋光鎳鈦表面,浸漬-干燥2次即產(chǎn)生明顯裂紋,可能由于涂層干燥過程中體積收縮導致。預制備多孔中間層后,鈦酸鹽 /TiO2多孔網(wǎng)絡在熱處理過程中發(fā)生致密化、結(jié)晶化[41],界面互鎖促進 TiO2涂層附著。鉭具有優(yōu)良的血液相容性,Dong 等[42] 在前驅(qū)體溶液中引入乙醇鉭,制備不同鉭 / 鈦原子比的 Ta-TiO2涂層。血小板黏附實驗結(jié)果顯示 TiO2涂層表面大量血小板聚集,形成團塊,添加鉭后只有少量血小板黏附,且形狀基本呈圓形,表明血液相容性得到改善。
2.5 化學氣相沉積
化 學 氣 相 沉 積(Chemical Vapor Deposition,CVD)可以簡單理解為高溫下氣相反應物發(fā)生解離,通過化學反應在基體上形成固態(tài)薄膜的過程。反應溫度取決于成膜物質(zhì)種類,化學氣相沉積過程中引入等離子體可以激發(fā)氣體分子,降低反應溫度,同時加速反應物在基體表面的擴散速率,提高成膜速率與薄膜均勻程度[43]。
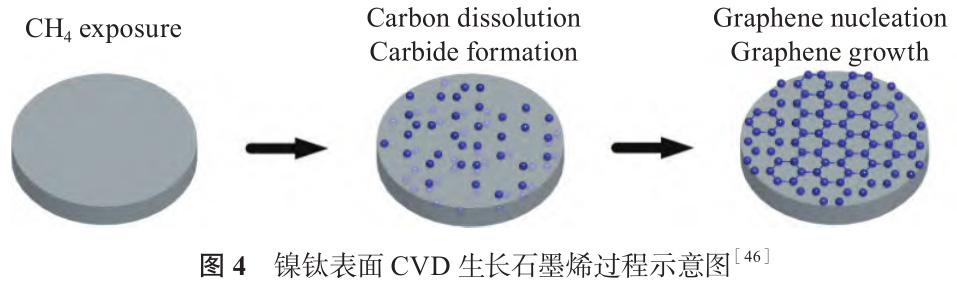
石墨烯是碳原子通過 sp2雜化方式結(jié)合形成的蜂窩狀二維材料,其誘導干細胞成骨分化的能力在生物工程領(lǐng)域引起很多關(guān)注[44,45]。CVD 法將含碳前驅(qū)體分解為碳原子,沉積到基體后成核、生長形成石墨烯,操作簡單、參數(shù)可控,是大面積制備石墨烯薄膜的有效方法。Li 等[46] 以甲烷為碳源,采用CVD 法在鎳鈦表面原位合成石墨烯薄膜,研究其形成機理。如圖 4 所示,由于鈦對碳的親和性比鎳高,鎳鈦表面形成碳化鈦,溶解度逐漸達到飽和,降溫時碳的溶解度降低,從基體析出形成石墨烯薄膜,碳化鈦的(111)晶面更利于石墨烯生長。
2.6 水熱法
水熱法(Hydrothermal Treatment)是指加熱密閉反應容器產(chǎn)生高溫高壓環(huán)境,以水溶液為反應介質(zhì),使難溶反應物溶解、重結(jié)晶生成目標產(chǎn)物。水熱法簡單方便,通過改變反應溫度、反應時間、前驅(qū)體種類及濃度、添加生長調(diào)節(jié)劑(極性有機分子等)可調(diào)控產(chǎn)物的粒徑、形態(tài)[47]。
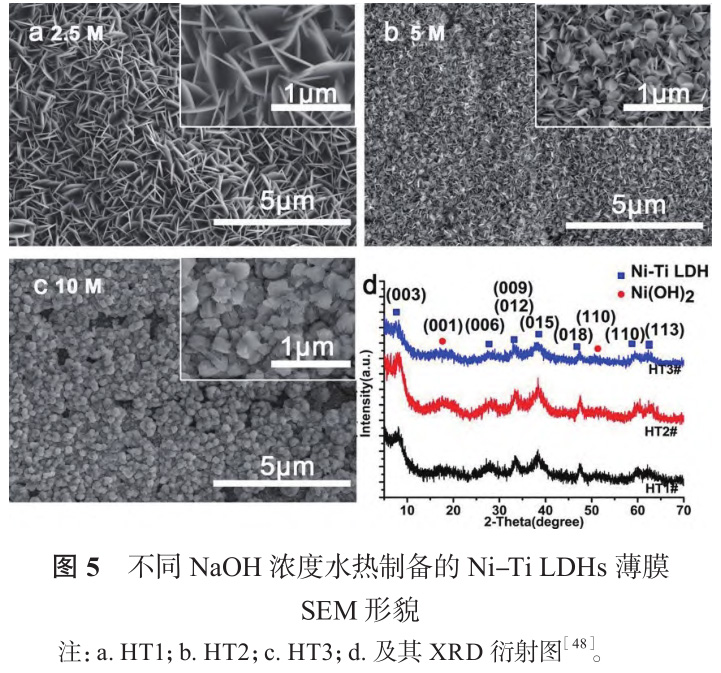
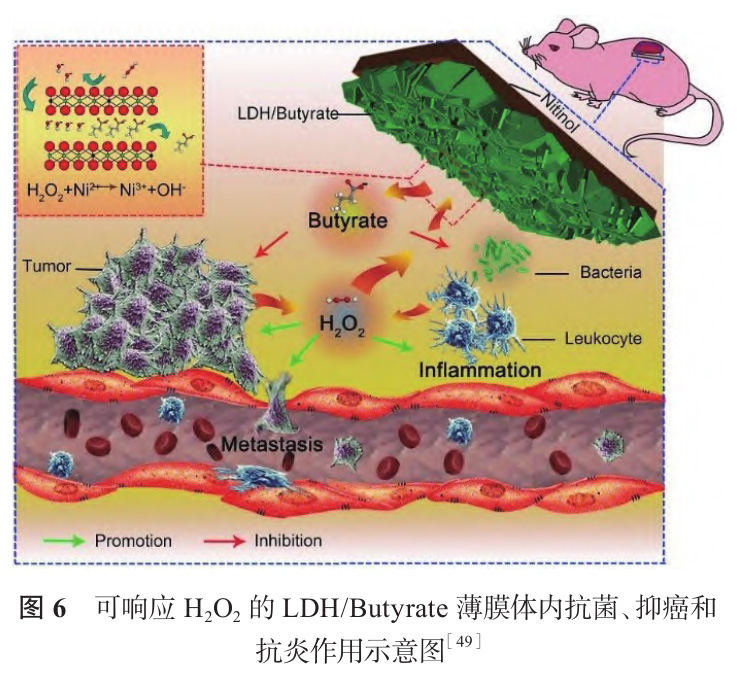
Wang 等[48] 在 NaOH 溶液中采用水熱處理制備了一系列不同鎳鈦比的鎳鈦層狀雙氫氧化物薄膜(Ni-Ti LDH)。如圖 5 所示,隨著 NaOH 濃度升高,納米片逐漸傾倒、聚集,最終形成顆粒。薄膜對腫瘤細胞具有選擇性抑制作用,由于腫瘤細胞微環(huán)境呈弱酸性,Ni-Ti LDH 分解釋放鎳離子,進入腫瘤細胞引起氧化應激,造成其凋亡。Wang 等[49] 以NiCl2、TiCl 4 和尿素混合液為前驅(qū)體,在鎳鈦表面合成含 CO 3 2- 和 CNO - 的 Ni-Ti LDH,并通過離子交換將抗腫瘤藥物丁酸根(Butyrate)負載于 LDH 板層間,構(gòu)建一個環(huán)境響應型抗菌抗腫瘤平臺(LDH/Butyrate),機理如圖 6 所示。腫瘤組織與細菌感染微環(huán)境富含 H2O2,LDH/Butyrate 可與 H2O2反應釋放丁酸根,實現(xiàn)抗菌抗腫瘤的目的,同時組織內(nèi) H2O 2濃度降低,有利于抑制腫瘤細胞轉(zhuǎn)移、緩解炎癥反應。
2.7 共價枝接
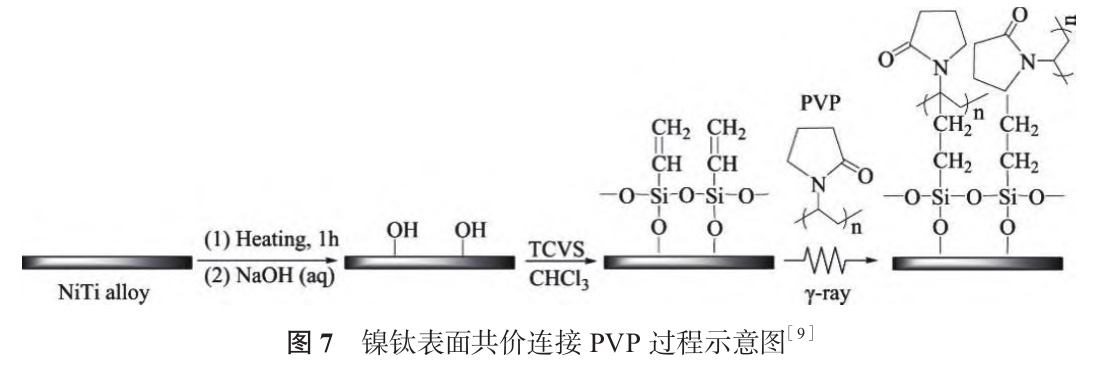
共價枝接(Covalent Grafting)是將涂層分子通過共價鍵固定到基體表面的改性方法,常用于金屬表面改性的枝接分子包括有機硅烷、聚乙二醇、多巴胺 / 聚多巴胺等[50,51]。Yu 等[9] 將預氧化的鎳鈦浸泡在三氯乙烯硅烷(TCVS)中進行硅烷化,通過γ-射線輻射將 PVP 枝接到鎳鈦表面,如圖 7 所示。固定 PVP 后,樣品親水性顯著提高,蛋白質(zhì)吸附量明顯減少。γ- 射線輻射過程中,TCVS 攜帶的乙烯基電離形成乙烯基自由基,聚乙二醇攜帶的烷基電離形成自由基后可與乙烯基自由基連接形成共價鍵,從而在硅烷化表面固定聚乙二醇,改善鎳鈦親水性,促進成骨細胞增殖[52]。
3、 復合表面改性
單一改性方法存在一定的局限性,可能無法完全滿足臨床需求,為了優(yōu)化鎳鈦表面性能,制備多功能生物涂層,需結(jié)合多種方法進行表面改性。Liu 等[53]發(fā)現(xiàn)經(jīng)過水熱處理納米孔轉(zhuǎn)變?yōu)榧{米線,延長水熱時間未對表面形貌產(chǎn)生明顯影響,相比納米孔和未處理鎳鈦,間充質(zhì)干細胞在在納米線表面增殖速率最快。
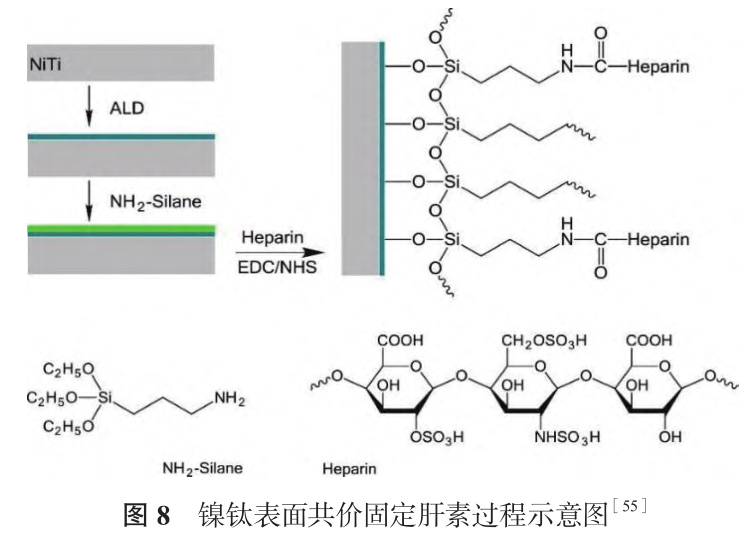
Viswanathan 等[54] 先采用 PIII 技術(shù)將氧氣注到鎳鈦表面,再利用陽極氧化將涂層氧含量增加至 94.3at.%,未處理鎳鈦表面氧含量為 75.9at.%,極化曲線結(jié)果表明高含氧量涂層呈現(xiàn)更好的耐腐蝕性能。肝素是天然抗凝血劑之一,表面肝素化是血液接觸材料常用的改性策略。如圖 8 所示,Wang 等[55]采用原子層沉積技術(shù)在鎳鈦表面沉積一層10nm 厚的氧化鋁中間層,再依次用偶聯(lián)劑 3- 氨基丙基三乙氧基硅烷(NH2-Silane)和肝素對氧化鋁覆蓋的表面進行改性。通過甲苯胺藍法評價肝素的穩(wěn)定性,將涂層浸入 PBS 中,肝素初始密度為(2.27±0.05)μg/cm2,37℃振蕩 30d 后密度為(1.96±0.05)μg/cm2,考慮到肝素本身是一種水溶性聚合物,表明共價枝接后涂層可以穩(wěn)定存在。由于肝素與水分子通過氫鍵和靜電作用形成水合層,抑制蛋白質(zhì)吸附,涂層表面纖維蛋白原吸附量和血小板聚集量明顯少于未改性鎳鈦,改性前后鎳鈦表面內(nèi)皮細胞密度、形態(tài)沒有顯著差異,表明涂層改性未產(chǎn)生細胞毒性。
4、 總結(jié)與展望
醫(yī)用鎳鈦合金表面鎳離子的過量釋放和生物惰性是制約其臨床使用效果的兩大關(guān)鍵問題,對其進行表面改性可在保留基體優(yōu)良力學性能的同時提高其生物安全性、賦予其生物學功能。本文將常用的表面改性方法分為物理表面改性、化學表面改性及復合改性,概述各類方法的改性機理和優(yōu)缺點,結(jié)合最新研究進展介紹各改性技術(shù)對于鎳鈦表面的作用機制,以及由此制備的具有特定功能的改性涂層;并深入分析改性涂層的化學組成、結(jié)合強度、粗糙度等理化性質(zhì)與制備工藝之間的聯(lián)系,闡述改性涂層對組織細胞的影響規(guī)律及作用機制。
盡管已有多種工藝技術(shù)用于鎳鈦合金表面改性,各表面改性方法構(gòu)建的涂層均存在一定局限。例如:等離子噴涂涂層與基體熱膨脹系數(shù)相差較大,可能產(chǎn)生較高殘余應力,降低涂層結(jié)合強度,且不適合表面結(jié)構(gòu)復雜的基體;等離子浸沒注入技術(shù)改性層較薄,只有 100nm 左右,生產(chǎn)成本較高;溶膠凝膠法制備的涂層與基體結(jié)合強度不足,特別是干燥和熱處理過程中涂層體積收縮可能引發(fā)裂紋;生長因子、多肽等生物分子價格較高,穩(wěn)定性較差,共價枝接到材料表面通常會影響其生物活性。因此,需根據(jù)臨床需求慎重選擇表面改性方法,充分發(fā)揮技術(shù)優(yōu)勢,避免或減輕負面影響。
對醫(yī)用鎳鈦合金進行表面改性可有效改善其耐蝕性和生物相容性,賦予其抗菌、成骨、促內(nèi)皮修復等生物學功能,但仍有許多問題需要重點關(guān)注。例如,人體不同部位對植入體有具體功能要求,需開發(fā)特定功能的生物安全涂層;涂層在動物和人體中與組織響應情況不同,暫時缺乏系統(tǒng)的臨床研究;此外,植入物在體內(nèi)常處于負載狀態(tài),目前對涂層抗疲勞
性能的研究仍較少。未來需更加科學全面地分析涂層理化性能對組織細胞的影響規(guī)律,為醫(yī)用鎳鈦合金進一步臨床應用提供理論基礎(chǔ)。
[ 參 考 文 獻 ]
[1] Mantovani D. Shape memory alloys properties and biomedical applications[J]. J Met, 2000, 52(10):36-44.
[2] Otsuka K, Ren X. Physical metallurgy of Ti–Ni-based shape memory alloys[J]. Prog Mater Sci, 2005, 50(5):511-678.
[3] Duerig TW, Tolomeo DE, Wholey M. An overview of superelastic stent design[J]. Minim Invasiv Ther 2000, 9(3-4):235-246.
[4] Hillen U, Haude M, Erbel R, et al. Evaluation of metal allergies in patients with coronary stents[J]. Contact Dermatitis, 2002, 47(6):353-356.
[5] Gristina AG. Biomaterial-centered infection-microbial adhesion versus tissue integration [J]. Science, 1987, 237(4822):1588-1595.
[6] Rae T. Study on effects of particulate metals of orthopedic interest on murine macrophages invitro[J]. J Bone Joint Surg Br, 1975, 57(4):444-450.
[7] Bergergorbet M, Broxup B, Rivard C, et al. Biocompatibility testing of NiTi screws using immunohistochemistry on sections containing metallic implants[J]. J Biomed Mater Res, 1996, 32(2):243-248.
[8] Takeshita F, Takata H, Ayukawa Y, et al. Histomorphometric analysis of the response of rat tibiae to shape memory alloy (nitinol)[J]. Biomaterials, 1997, 18(1):21-25.
[9] Yu H, Liu Y, Wang Y, et al. A study on poly (N-vinyl-2-pyrrolidone) covalently bonded NiTi surface for inhibiting protein adsorption[J]. Prog Nat Sci: Mater Int, 2016, 26(6):584-589.
[10] Yang S, Li WH, Man HC. Laser cladding of HA/Ti composite coating on NiTi alloy[J]. Surf Eng, 2013, 29(6):409-413.
[11] Say Y, Aksakal B. Silver/Selenium/Chitosan-doped Hydroxyapatite coatings on biological NiTi alloy: In vitro biodegradation analysis[J]. J Sol-Gel Sci Technol, 2019, 90(2):434-442.
[12] Chou BY, Chang E. Influence of deposition temperature on mechanical properties of plasma-sprayed hydroxyapatite coating on titanium alloy with ZrO2intermediate layer[J]. J Therm Spray Technol, 2003, 12(2):199-207.
[13] Garcia-Alonso D, Parco M, Stokes J, et al. low-energy plasma spray (leps) deposition of hydroxyapatite/poly-epsilon-caprolactone biocomposite coatings[J]. J Therm Spray Technol, 2012, 21(1):132-143.
[14] Gu YW, Khor KA, Pan D, et al. Activity of plasma sprayed yttria stabilized zirconia reinforced hydroxyapatite/Ti-6Al-4V composite coatings in simulated body fluid[J].Biomaterials, 2004, 25(16):3177-3185.
[15] Prymak O, Bogdansk D, Esenwein SA, et al. NiTi shape memory alloys coated with calcium phosphate by plasma-spraying. Chemical and biological properties[J].Materialwiss Werkst, 2004, 35(5):346-351.
[16] 尹大宇,朱錦宇,段永宏. 生物醫(yī)用鎳鈦合金表面鉭涂層腐蝕行為研究[J]. 華南國防醫(yī)學雜志,2011,25(1):52-56.
[17] Ji H, Chu C, Wang R, et al. Preparation of zirconium fi lm on NiTi shape memory alloy surface by magnetron sputtering and investigation of its structure[J]. Rare Metal Mat Eng, 2009,38(2):295-298.
[18] Yuan B, Li H, Gao Y, et al. In vitro and in vivo evaluation of porous NiTi alloy modified by sputtering a surface TiO2fi lm[J]. Sci China-Technol Sc, 2012, 55(2):437-444.
[19] Chu PK. Progress in direct-current plasma immersion ion implantation and recent applications of plasma immersion ion implantation and deposition[J]. Surf Coat Tech, 2013, 229:2-11.
[20] Maleki-Ghaleh H, Khalil-Allafi J, Sadeghpour-Motlagh M, et al. Effect of surface modification by nitrogen ion implantation on the electrochemical and cellular behaviors of super-elastic NiTi shape memory alloy[J]. J Mater Sci-Mater M, 2014, 25(12):2605-2617.
[21] Sui JH, Cai W. Formation of diamond-like carbon (DLC)fi lm on the NiTi alloys via plasma immersion ion implantation and deposition (PIIID) for improving corrosion resistance[J].Appl Surf Sci, 2006, 253(4):2050-2055.
[22] Zhao T, Yang R, Zhong C, et al. Effective inhibition of nickel release by tantalum-implanted TiNi alloy and its cyto-compatibility evaluation in vitro[J]. J Mater Sci, 2011, 46(8):2529-2535.
[23] Wu L, Tan J, Chen S H, et al. Catalyst-enhanced micro-galvanic effect of Cu 3 N/Cu-bearing NiTi alloy surface for selective bacteria killing[J]. Chem Eng J, 2022, 447:137484.
[24] Wei C, Zhang HF, Tan J, et al. Nickel nitride-mediated nitric oxide generation for combating implant-associated infections[J].Chem Eng J, 2024, 490:151566.
[25] Zhang S, Tang H, Hu F, et al. Electrochemical corrosion behavior of laser gas nitrided layer on the NiTi shape memory alloy in Hank’s solution[C]. Mater Manuf, Pts 1 and 2,2011:179-182.
[26] Ng CH, Rao N, Law WC, et al. Enhancing the cell proliferation performance of NiTi substrate by laser diff usion nitriding[J]. Surf Coat Tech, 2017, 309:59-66.
[27] Khalili V, Naji H. Developing a mechanochemical surface pretreatment to increase the adhesion strength of hydroxyapatite electrophoretic coating on the NiTi alloy as a bone implant[J].Surf Coat Tech, 2020, 397:125985.
[28] Farnoush H, Mohandesi JA, Cimenoglu H. Micro-scratch and corrosion behavior of functionally graded HA-TiO2nanostructured composite coatings fabricated by electrophoretic deposition[J]. J Mech Behav Biomed, 2015,46:31-40.
[29] Parente P, Sanchez-Herencia AJ, Mesa-Galan MJ,et al. Functionalizing Ti-Surfaces through the EPD of Hydroxyapatite/NanoY2O 3 [J]. J Phys Chem B, 2013, 117(6):1600-1607.
[30] Laonapakul T, Nimkerdphol AR, Otsuka Y, et al. Failure behavior of plasma-sprayed HAp coating on commercially pure titanium substrate in simulated body fl uid (SBF) under bending load[J]. J Mech Behav Biomed, 2012, 15:153-166.
[31] Vladescu A, Padmanabhan SC, Azem FA, et al. Mechanical properties and biocompatibility of the sputtered Ti doped hydroxyapatite[J]. J Mech Behav Biomed, 2016, 63:314-325.
[32] Horandghadim N, Khalil-Allafi J, Urgen M. Influence of tantalum pentoxide secondary phase on surface features and mechanical properties of hydroxyapatite coating on NiTi alloy produced by electrophoretic deposition[J]. Surf Coat Tech,2020, 386:125458.
[33] Li P, Zhang X, Xu R, et al. Electrochemically deposited chitosan/Ag complex coatings on biomedical NiTi alloy for antibacterial application[J]. Surf Coat Tech, 2013, 232:370-375.
[34] Hammad SM, El-Wassefy NA, Shamaa MS, et al. Evaluation of zinc-oxide nanocoating on the characteristics and antibacterial behavior of nickel-titanium alloy[J]. Dental Press J Orthod, 2020, 25(4): 51-58.
[35] Guan D, Fang H, Lu H, et al. Preparation and doping of anodic TiO2nanotube array[J]. Prog Chem, 2008, 20(12):1868-1879.
[36] Ohtste N, Hirano Y, Yamaguchi K, et al. Surface characteristics, Ni ion release, and antibacterial efficacy of anodized NiTi alloy using HNO 3 electrolyte of various concentrations[J]. Appl Surf Sci, 2019, 492:785-791.
[37] Hang R, Liu Y, Bai L, et al. Length-dependent corrosion behavior, Ni 2+ release, cytocompatibility, and antibacterial ability of Ni-Ti-O nanopores anodically grown on biomedical NiTi alloy[J]. Mat Sci Eng C-Mater, 2018, 89:1-7.
[38] Yesildal R, Karabudak F, Sukuroglu EE, et al. Differential scanning calorimetry (DSC) and Ni 2+ release analysis of NiTi-shape-memory dental alloys coated by micro-arc oxidation (MAO) method[J]. Appl Phys A-Mater, 2018,124(8):572.
[39] Livage J, Henry M, Sanchez C. Sol-gel chemistry of transition-metal oxides[J]. Prog Solid State Chem, 1988, 18(4):259-341.
[40] Fu T, Liu B G, Zhou Y M, et al. Sol-gel titania coating on NiTi alloy with a porous titania fi lm as interlayer[J]. J Sol-Gel Sci Technol, 2011, 58(1):307-311.
[41] Kokubo T, Kim HM, Kawashita M, et al. Bioactive metals:preparation and properties[J]. J Mater Sci-mater M, 2004,15(2):99-107.
[42] Dong B-H, Wu F, Alajmi Z, et al. Sol-gel derived Ta-containing TiO2fi lms on surface roughened NiTi alloy[J].Rare Metals, 2014, 33(1):21-27.
[43] Zhang XM, Qiu JJ, Tan J, et al. In-situ growth of vertical graphene on titanium by PECVD for rapid sterilization under near-infrared light[J]. Carbon, 2022, 192:209-218.
[44] Kostarelos K, Novoselov KS. Exploring the interface of graphene and biology[J]. Science, 2014, 344(6181):261-263.
[45] Luo Y, Shen H, Fang Y, et al. Enhanced proliferation and osteogenic differentiation of mesenchymal stem cells on graphene oxide-incorporated electrospun poly(lactic-co-glycolic acid) nanofi brous mats[J]. Acs Appl Mater Inter,2015, 7(11):6331-6339.
[46] Li J, Wang G, Geng H, et al. CVD growth of graphene on NiTi alloy for enhanced biological activity[J]. Acs Appl Mater Inter, 2015, 7(36):19876-19881.
[47] Canu G, Buscaglia V. Hydrothermal synthesis of strontium titanate: thermodynamic considerations, morphology control and crystallisation mechanisms[J]. Crystengcomm, 2017,19(28):3867-3891.
[48] Wang D, Ge N, Li J, et al. Selective tumor cell inhibition eff ect of Ni-Ti layered double hydroxides thin fi lms driven by the reversed pH gradients of tumor cells[J]. Acs Appl Mater Inter, 2015, 7(15):7843-7854.
[49] Wang D, Peng F, Li J, et al. Butyrate-inserted Ni-Ti layered double hydroxide fi lm for H2O2-mediated tumor and bacteria killing[J]. Mater Today, 2017, 20(5):238-257.
[50] Simsekyilmaz S, Liehn EA, Weinandy S, et al. Targeting in-stent-stenosis with RGD- and CXCL1-coated mini-stents in mice[J]. PLoS One, 2016, 11(5):e0155829.
[51] Sargeant TD, Rao MS, Koh CY, et al. Covalent functionalization of NiTi surfaces with bioactive peptide amphiphile nanofi bers[J]. Biomaterials, 2008, 29(8):1085-1098.
[52] Yu H, Yan J, Ma H, et al. Creating poly(ethylene glycol) fi lm on the surface of NiTi alloy by gamma irradiation[J].Radiat Phys Chem, 2015, 112:199-202.
[53] Liu S, Zhao Y, Liu Y, et al. Preparation and cytocompatibility of Ni-Ti-O nanospindles on NiTi alloy[J]. Mater Lett, 2019, 257:126697.
[54] Viswanathan S, Mohan L, Bera P, et al. Effect of oxygen plasma immersion ion implantation on the formation of nanostructures over Ni-Ti alloy[J]. Rsc Adv, 2016, 6(78):74493-74499.
[55] Wang F, Zhang Y, Chen XM, et al. ALD mediated heparin grafting on nitinol for self-expanded carotid stents[J].Colloid Surface B, 2016, 143:390-398.
無相關(guān)信息


sxxlti.com
旭隆金屬手機網(wǎng)